Un sistema de eliminación de ADN defectuoso causa inflamación
Los científicos de Salk mapean la vía de la inflamación en células de ratón desde el estrés mitocondrial hasta la fuga endosómica y la iniciación del sistema inmunológico, revelando nuevos objetivos terapéuticos potenciales para reducir la inflamación en el envejecimiento y las enfermedades.
LA JOLLA — Las células del cuerpo humano contienen mitocondrias productoras de energía, cada una con su propio ADNmt, un conjunto único de instrucciones genéticas completamente separadas del ADN nuclear de la célula que las mitocondrias utilizan para producir energía vital. Cuando el ADNmt permanece en su lugar (dentro de las mitocondrias), mantiene la salud mitocondrial y celular, pero cuando va a algún lugar al que no pertenece, puede iniciar una respuesta inmune que promueve la inflamación.

Haga clic aquí para obtener una imagen de alta resolución.
Crédito: Instituto Salk
Ahora, los científicos y colaboradores de Salk en UC San Diego han descubierto un nuevo mecanismo utilizado para eliminar el ADNmt que funciona mal desde el interior de las mitocondrias hacia el exterior. Cuando esto sucede, el ADNmt se reconoce como ADN extraño y activa una vía celular que normalmente se utiliza para promover la inflamación y eliminar patógenos de la célula, como los virus.
Resultados publicados en Biología celular normal 8 de febrero de 2024 Se presentan varios objetivos terapéuticos nuevos para alterar la vía inflamatoria y así mitigar la inflamación durante el envejecimiento y enfermedades como el lupus o la artritis reumatoide.
«Sabíamos que el ADNmt estaba escapando de las mitocondrias, pero no está claro cómo», dice el profesor Gerald Shadel, principal y coautor, director del Centro de Excelencia en Traumatología en Biología Básica del Envejecimiento de San Diego-Nathan y ganador del Premio Audrey Geisel. . Cátedra de Ciencias Biomédicas del SALIC. «Utilizando métodos de imagen y biología celular, podemos rastrear los pasos de la vía para transportar el ADN mitocondrial fuera de las mitocondrias, a los que ahora podemos intentar abordar con intervenciones terapéuticas para, con suerte, prevenir la inflamación resultante».
Una forma en que nuestras células responden al daño y la infección es lo que se conoce como sistema inmunológico innato. Si bien la respuesta inmune innata es la primera línea de defensa contra los virus, también puede responder a moléculas producidas por el cuerpo que simplemente se parecen a los patógenos, incluido el ADN mitocondrial fuera de lugar. Esta respuesta puede provocar inflamación crónica y contribuir a las enfermedades y el envejecimiento humanos.
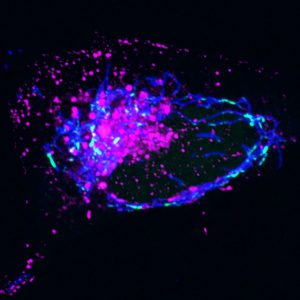

Haga clic aquí para obtener una imagen de alta resolución.
Crédito: Instituto Salk
Los científicos han estado trabajando para descubrir cómo el ADN mitocondrial sale de las mitocondrias y estimula la respuesta inmune innata, pero las vías identificadas previamente no se aplicaban a las condiciones únicas de estrés del ADN mitocondrial que el equipo de Salk estaba investigando. Entonces, recurrieron a sofisticadas técnicas de imágenes para recopilar pistas sobre dónde y cuándo las cosas iban mal en esas mitocondrias.
«Tuvimos un gran avance cuando vimos que el ADN mitocondrial estaba dentro de una misteriosa estructura membranosa una vez que abandonaba las mitocondrias, y después de juntar todas las piezas del rompecabezas, nos dimos cuenta de que la estructura era un endosoma», dice el primer autor. Laura Newman, ex investigador postdoctoral en el laboratorio de Shadle y actual profesor asistente en la Universidad de Virginia. «Este descubrimiento finalmente nos llevó a darnos cuenta de que el ADN mitocondrial se estaba descartando y, en el proceso, parte de él se estaba filtrando».
El equipo descubrió un proceso que comienza con un defecto en la replicación del ADN mitocondrial que provoca la acumulación de grupos de proteínas que contienen ADNmt llamados nucleoides dentro de las mitocondrias. Después de notar este defecto, la célula comienza a eliminar los nucleoides que detienen la replicación transportándolos a los endosomas, un grupo de orgánulos que clasifica y envía material celular para su eliminación permanente. El endosoma se sobrecarga con estos nucleoides, lo que provoca una fuga y el ADN mitocondrial se desensambla repentinamente en la célula. La célula indica que el ADNmt es ADN extraño (de la misma manera que indica el ADN viral) e inicia la vía cGAS-STING para detectar el ADN y causar inflamación.
«Utilizando nuestras herramientas de imágenes de vanguardia para examinar la dinámica mitocondrial y la liberación de ADNmt, hemos descubierto un mecanismo de liberación de ADNmt completamente nuevo», dice el coautor Uri Manor, ex director del Waitt Advanced Biophotonics Core en Salk y actual profesor asistente. En la Universidad de California, San Diego. «Hay muchas preguntas de seguimiento que estamos ansiosos por hacer, como cómo otras interacciones entre orgánulos controlan las vías inmunes innatas, cómo los diferentes tipos de células liberan ADNmt y cómo podemos abordar esta nueva vía para reducir la inflamación durante la enfermedad y envejecimiento.»
Los investigadores esperan trazar más detalles sobre esta compleja vía de eliminación del ADN mitocondrial y activación inmune, incluidas las condiciones biológicas (como la disfunción de la replicación del ADN mitocondrial y la infección viral) que se requieren para iniciar la vía y qué efectos posteriores puede tener sobre salud humana. También ven una oportunidad para la innovación terapéutica utilizando esta vía, que representa un nuevo objetivo celular para reducir la inflamación.
Otros autores incluyen a Sammy Weiser Novak, Gladys Rojas, Nimisha Tadepal, Cara Schiavone, Cristina Towers, Matthew Donnelly, Sajnika Ghosh, Sienna Rocha y Ricardo Rodríguez Enríquez de Salk; Danielle Grotjahn y Michaela Medina del Instituto de Investigación Scripps; Marie-Eve Tremblay de la Universidad de Victoria en Canadá; Joshua Chives de la Universidad de California, San Diego; e Ian Lemmersall del Instituto de Inmunología de La Jolla.
El trabajo fue apoyado por los Institutos Nacionales de Salud (R01 AR069876, P30AG068635, 1K99GM141482, 1F32GM137580, T32GM007198, 5R00CA245187 y 5R00CA245187-04S1), la Iniciativa Allen-AHA en salud cerebral y deterioro cognitivo (1) 9 PABH1346.10000H), Nacional Premio NeuroNex de la Fundación Científica (2014862), Premio Chan Zuckerberg Scholars of Photography, Fundación LIFE, George E. Beca posdoctoral de investigación médica Hewitt, beca posdoctoral de la Fundación de Investigación Médica Paul F. Glenn, beca posdoctoral del Fondo Salk Pioneer, premio Waitt. La Fundación del Centro de Imágenes Celulares y Moleculares de la Facultad de Medicina de la Universidad de Yale, la Cátedra de Investigación de Canadá (Nivel 2) en Neurobiología del Envejecimiento y la Cognición y la Fundación Canadiense para la Innovación John R. Evans Leaders Fund (Subvención 39965).
Identificación digital: 10.1038/s41556-023-01343-1

«Alborotador. Amante de la cerveza. Total aficionado al alcohol. Sutilmente encantador adicto a los zombis. Ninja de twitter de toda la vida».





More Stories
China Daily » Noticias capitales
En la Inglaterra medieval, la lepra se transmitía entre ardillas y humanos: ScienceAlert
Evolución de la actividad de las llamaradas en estrellas GKM menores de 300 Ma durante cinco años de observaciones TESS