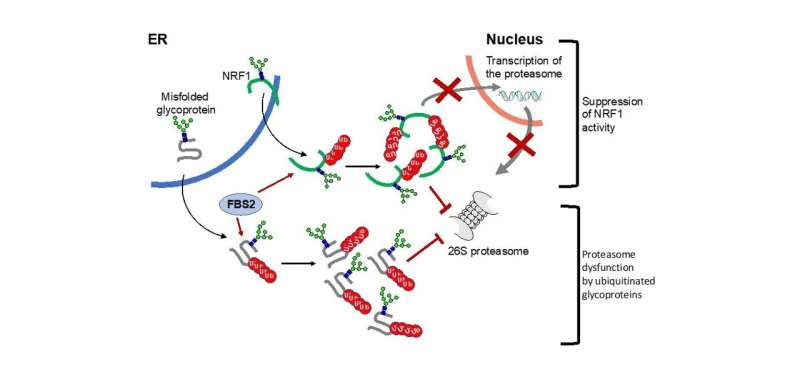
Modelo esquemático del mecanismo de disfunción del proteasoma por FBS2 en la deficiencia de NGLY1. FBS2 causa citotoxicidad en ausencia de NGLY en dos etapas. Primero, FBS2 está presente en sustratos de glicoproteína desplegados. Las glicoproteínas que se coadministran con el proteasoma pueden inhibir gravemente la actividad del proteasoma, debido a la presencia de los glicanos. La acumulación de glicoproteínas ubiquitinadas conduce a la inhibición del proteasoma. Las células detectan la inhibición del proteasoma e intentan inducir la activación transcripcional de las subunidades del proteasoma mediante NRF1 activo. Pero FBS2 suprime bloqueando la importación nuclear de NRF1. Además, la NRF1 inducida también causa disfunción de la proteasa como sustratos de glicoproteína ubiquitinada. crédito: TMIMS
Péptido citosólico: la N-glucanasa (NGLY1) es una enzima ampliamente conservada que interviene en la eliminación de la N-glucosilación de las proteínas N-glucosiladas. Las mutaciones en el gen NGLY1 humano causan retraso en el desarrollo y síntomas multisistémicos, pero el mecanismo molecular subyacente a la patogénesis aún no se conoce bien.
La pérdida de mutaciones en NGLY1, una enzima que elimina las cadenas de azúcar, causa un trastorno del desarrollo multisistémico llamado deficiencia de NGLY1. Investigadores del Instituto Metropolitano de Ciencias Médicas de Tokio (TMiMS), la Universidad de Kyoto, RIKEN y T-CiRA en Japón han explicado la patogénesis de la deficiencia de NGLY1. Descubrieron que cuando NGLY1 es deficiente, una cantidad masiva de glicoproteínas, ubicuamente ubicuas por la ubiquitina ligasa que reconoce el azúcar, causa complejo de proteínas en la célula Desequilibrio que conduce a la citotoxicidad. El informe se publica en PNAS.
El péptido N-glicanasa (NGLY1) es una enzima conservada evolutivamente para eliminar los glicanos ligados a N (N-glicanos) de las glicoproteínas y está involucrado en las N-glicoproteínas en el citosol. En 2012, un trastorno genético raro La deficiencia de NGLY1 se detectó mediante análisis de exoma. Los síntomas en pacientes con deficiencia de NGLY1 incluyen retraso del crecimiento sistémico, hipotonía, hipoacrimación, trastorno del movimiento, escoliosis, función anormal del hígado y el cerebro y neuropatía periférica. Desafortunadamente, actualmente no se dispone de un tratamiento curativo para esta devastadora enfermedad, porque aún no se comprende el mecanismo exacto del daño. Hasta la fecha, el equipo del Dr. Suzuki en RIKEN y T-CiRA ha desarrollado diferentes modelos animales de deficiencia de NGLY1 e informó que la eliminación de NGLY1 en ratones B6 es embriológicamente letal.
En el citosol, hay otras proteínas involucradas en el procesamiento de glicoproteínas. Uno de esos grupos de proteínas son las unidades de ubiquitina ligasa de la glicoproteína, FBS (proteínas de caja F que reconocen las cadenas de azúcar), que forman las glicoproteínas desplegadas en el citosol. La ubicuidad de las proteínas actúa como señales para la proteólisis por parte del proteasoma, la maquinaria proteolítica esencial para las proteínas celulares y la salud. Los autores encontraron que la deleción del gen que codifica FBS2, una de las proteínas FBS, restauró la tasa de letalidad de los ratones NGLY1-KO B6 y FBS2; Los ratones NGLY1 double-KO crecieron sin anomalías obvias. Este hallazgo revela que la actividad de FBS2 puede causar la muerte en embriones de ratones NGLY1-KO.
Los efectos adversos de FBS2 también se observaron en ausencia de NGLY1 en células de cultivo. Los autores señalan que la sobreexpresión de FBS2 en las líneas celulares NGLY1-KO limita el crecimiento celular y, en última instancia, conduce a la muerte celular. Las glucoproteínas circulantes FBS2 que no pudieron eliminar las glucoproteínas en ausencia de NGLY1 y las glucoproteínas circulantes no se degradaron ni se acumularon en las células. Las proteínas con proliferación de proteasomas suelen degradarse, pero las glicoproteínas ubiquitinadas provocan la inactivación del proteasoma. La inhibición prolongada del proteasoma conduce a la muerte celular. Para mantener la función del proteasoma, células Estimulación de la síntesis de nuevos proteasomas por el factor de transcripción NRF1 ante la disfunción del proteasoma. Es interesante que NRF1 sea un archivo glicoproteína Reside en el retículo endoplásmico y es degradado por el proteasoma en condiciones normales. Cuando se suprime la actividad del proteasoma, NRF1 se estabiliza y se transporta al núcleo donde activa la transcripción del proteasoma. Sin embargo, en ausencia de NGLY1, FBS2 era omnipresente en NRF1 y reprimía su actividad transcripcional de proteasoma. Por tanto, FBS2 inhibe la actividad de la proteasa y también altera la función de recuperación de las proteasas en la pérdida de NGLY1. También se observó que NRF1 era ubicuo en embriones de ratones NGLY1-KO.
Este trabajo allana el camino para el desarrollo de tratamientos para esta enfermedad incurable.
Yukiko Yoshida et al, Pérdida de péptidos: la N-glicanasa causa una disfunción del proteasoma mediada por la ubiquitina ligasa que reconoce el azúcar, procedimientos de la Academia Nacional de Ciencias (2021). DOI: 10.1073 / pnas.2102902118
Presentado por el Instituto Metropolitano de Ciencias Médicas de Tokio
La frase: Estudio muestra cómo la pérdida de des-N-glicosilación causa un efecto negativo (2021, 6 de julio). mal efecto. html
Este documento está sujeto a derechos de autor. Sin perjuicio de cualquier trato justo con el propósito de estudio o investigación privada, ninguna parte puede ser reproducida sin permiso por escrito. El contenido se proporciona únicamente con fines informativos.

«Alborotador. Amante de la cerveza. Total aficionado al alcohol. Sutilmente encantador adicto a los zombis. Ninja de twitter de toda la vida».





More Stories
Formación de formadores expertos en Libia – IARC
TESS encuentra su primer planeta rebelde
Los médicos combinaron una bomba cardíaca y un trasplante de riñón de cerdo en una cirugía avanzada