Los científicos de Stowers infieren la estructura primaria del amiloide implicado en la enfermedad de Huntington y ofrecen un enfoque terapéutico potencial
ciudad de Kansasextraña.Y 13 de junio de 2023 /PRNewswire/ — Enfermedades neurodegenerativas devastadoras como la enfermedad de Huntington, el Alzheimer y el Parkinson están relacionadas con los depósitos de una proteína en el cerebro, conocida como amiloide. A pesar de la extensa inversión en investigación sobre la causa y la toxicidad del amiloide, sigue siendo difícil descifrar el primer paso en la formación junto con tratamientos efectivos.
El coinvestigador Randall Halfman, PhD, analiza una nueva investigación que revela la aparición de la enfermedad de Huntington.
Gráficos de DAmFret que muestran el grado de autoensamblaje de glutamina (Q) a medida que aumenta el número de secuencias Qs (izquierda: Qs menos de 36; centro: Qs alrededor de 50; derecha: Qs más de 100).
Micrografías de vida útil de fluorescencia de una proteína humana marcada con fluorescencia dentro de las células de levadura. Diferentes colores indican diferentes estados de agregación de proteínas.
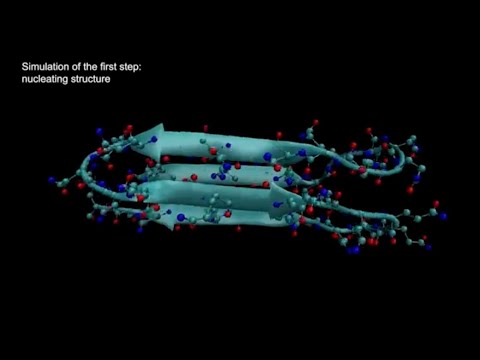
Por primera vez, los científicos de Instituto Stowers de Investigación Médica Descubrieron la estructura del primer paso en la formación de amiloide, llamado nucléolo, de la enfermedad de Huntington. el Quédate Publicado en eLife en 13 de junio de 2023de un laboratorio Co-investigador Randall medio hombreDoctor.propone una nueva forma radical de tratar no solo la enfermedad de Huntington, sino potencialmente docenas de otras enfermedades relacionadas con el amiloide, para evitar que ocurra el paso inicial limitante de la tasa.
«Esta es la primera vez que alguien determina experimentalmente la estructura del núcleo amiloide a pesar de que la mayoría de las principales enfermedades neurodegenerativas están relacionadas con el amiloide», dijo Halfman. «Uno de los grandes misterios de la enfermedad de Huntington, la enfermedad de Alzheimer y la esclerosis lateral amiotrófica es por qué la enfermedad coexiste con el amiloide, pero el amiloide en sí mismo no es la causa principal».
Primeros coautores Tej Candoladoctorado y Shriram VenkatesanPh.D., identificó de manera única la estructura del núcleo amiloide de la Huntingtina, la proteína responsable de la enfermedad de Huntington, y descubrió que el núcleo se forma dentro de una sola molécula de proteína.
Las proteínas son los trabajadores de fábrica de la célula que se crean a partir de secuencias únicas de 20 aminoácidos y son sus componentes básicos. Algunas proteínas contienen repeticiones de uno de estos aminoácidos, la glutamina (abreviada como Q). La enfermedad de Huntington y otras ocho enfermedades, denominadas colectivamente «enfermedades PolyQ», ocurren cuando ciertas proteínas se repiten durante demasiado tiempo. De alguna manera, esto hace que las proteínas se plieguen en una estructura específica que inicia una reacción en cadena que mata a la célula.
«Durante tres décadas hemos sabido que la enfermedad de Huntington y las enfermedades fatales relacionadas ocurren cuando las proteínas tienen más de 36 qs seguidas, lo que hace que se formen cadenas de proteínas en el cerebro, pero no sabíamos por qué», dijo Halfman. . «Ahora hemos descubierto cómo se ve el primer enlace de la serie y, al hacerlo, hemos descubierto una nueva forma de detenerlo».
«Francamente, me sorprende que haya surgido un modelo físico de nucleación tan intuitivo a pesar de la complejidad intrínseca del entorno celular». Señor jeremy schmidtDoctor.de Universidad Estatal de Kansas.
“Estoy realmente entusiasmado con la intuición y las hipótesis comprobables que inspira este trabajo”.
Un salto cuántico y un posible método terapéutico
Estos nuevos hallazgos tienen el potencial de ser un cambio de paradigma en la forma en que vemos el amiloide. Los resultados de esta investigación indican que los primeros pasos comprometidos de la formación de amiloide, inmediatamente después de la formación del núcleo, son los que provocan la muerte de las neuronas.
Además de revelar la estructura primaria que inicia la formación de amiloide polyQ, los investigadores descubrieron que solo se forma en moléculas aisladas de la proteína. Las proteínas que se agrupaban en las células detuvieron por completo la formación de amiloide. Esta es una nueva modalidad de tratamiento que el equipo planea explorar más a fondo en ratones y organoides cerebrales.
nueva tecnología
Una técnica desarrollada recientemente por el laboratorio de Halfmann, Distributed Amphifluoric Förster Resonance Energy Transfer (DAmFRET), muestra cómo una proteína se autoensambla en células individuales. Se ha demostrado que este método es crítico para monitorear el evento de nucleación limitante de la velocidad del amiloide.
«Una de las principales innovaciones fue reducir el volumen de reacción hasta el punto en que podemos presenciar la aleatoriedad o la aleatoriedad, y luego ajustar la secuencia para ver qué gobierna eso», dijo Havemann.
El diseño y la prueba de patrones específicos de Q permitieron al equipo deducir la estructura mínima que puede formar el amiloide: un paquete de cuatro filamentos, cada uno con tres Q en ubicaciones específicas. Este pequeño cristal dentro de una sola molécula de proteína es el primer paso en una reacción en cadena que resulta en una enfermedad.
“El trabajo de probeta anterior admite núcleos únicos, pero este modelo ha sido controvertido”, dijo Halfman. «Ahora tenemos pruebas sólidas de que 36 Qs es el número crítico para que ocurra la nucleación en moléculas de proteína individuales y, además, que así es como ocurre dentro de las células vivas».
En esencia, este trabajo proporciona un modelo molecular para examinar la estructura de cualquier núcleo amiloide. Además, la relación entre el envejecimiento y el amiloide sugiere que este método eventualmente podría revelar los mecanismos moleculares que causan el envejecimiento. Un enfoque preventivo para eliminar o al menos retrasar la nucleación ofrece esperanza a las personas con proteínas PolyQ patológicas.
«El modelo emergente es que todo proviene de un solo evento, un cambio espontáneo en la forma de la proteína», dijo Halfman. «Este evento enciende la reacción en cadena de amiloide que mata las células y puede proporcionar información cómo El amiloide causa enfermedades”.
Otros autores incluyen jiahui zhangdoctorado, Brooklyn Lierbakken, alex von schulzedoctorado, Gillian F. Blank, Jian Zheng WuDoctor., jay unruhDoctor., paula bayaY jeffrey langDoctor., andres cajaY malcolm cocineroY celeste flacidezDoctor.
Este trabajo fue financiado por el Instituto Nacional de Ciencias Médicas Generales de los Institutos Nacionales de Salud (NIH) (Premio: R01GM130927) y con el apoyo institucional del Instituto Stowers para la Investigación Médica. El contenido es responsabilidad exclusiva de los autores y no representa necesariamente los puntos de vista oficiales de los Institutos Nacionales de Salud.
Acerca del Instituto de Investigación Médica Stowers
Fundada en 1994 gracias a la generosidad Jim tiendas, fundador de American Century Investments, y su esposa, Virginia, Stowers Institute for Medical Research es una organización de investigación biomédica sin fines de lucro que se enfoca en la investigación fundamental. Su misión es expandir nuestra comprensión de los misterios de la vida y mejorar la calidad de vida a través de enfoques innovadores para las causas, el tratamiento y la prevención de enfermedades.
El instituto consta de 17 programas de investigación independientes. Entre los casi 500 miembros, hay más de 370 miembros del personal científico que incluyen investigadores principales, directores de centros técnicos, becarios posdoctorales, estudiantes graduados y personal de apoyo técnico. Conoce más sobre el instituto en www.stowers.org Y sobre su programa de posgrado en www.stowers.org/gradschool.
Contacto con los medios:
joe chiodoJefe de Relaciones con los Medios
724,462,8529
[email protected]
FUENTE Instituto Stowers de Investigación Médica

«Alborotador. Amante de la cerveza. Total aficionado al alcohol. Sutilmente encantador adicto a los zombis. Ninja de twitter de toda la vida».






More Stories
¿Cómo afecta un eclipse solar a la Tierra?
Una nebulosa extiende su mano hacia el espacio.
¿Pueden las células cerebrales de ratón ayudar a que los órganos humanos crezcan en animales? Un nuevo estudio proporciona evidencia