Empezar
Vea una demostración de este experimento y descargue las notas técnicas de educacion en quimica Sitio web: rsc.li/WHEELBARROW
El movimiento aleatorio de las partículas explica muchos fenómenos espontáneos. Aunque los procesos de difusión pueden observarse en gases muy rápidamente, demostraciones similares en líquidos pueden ser frustrantemente lentas. Se colocó un cristal de permanganato de potasio (KMnO)4) Tomará la mayor parte de la lección disolverse y esparcirse por la base de la taza.
En esto Variación de la reacción de las células de Traube.En la imagen, se muestra una burbuja de líquido azul primero flotando y luego hundiéndose a medida que el agua se difunde en el líquido amarillo circundante, lo que muestra la difusión de las moléculas de agua en segundos. Puede explorar la difusión y la densidad con entre 11 y 14 alumnos mediante esta demostración. También puede utilizar esta demostración con entre 16 y 18 alumnos para desarrollar su comprensión de la química de los metales de transición y perfeccionar su preparación de soluciones estándar.
El movimiento aleatorio de las partículas explica muchos fenómenos espontáneos. Aunque los procesos de difusión pueden observarse en gases muy rápidamente, demostraciones similares en líquidos pueden ser frustrantemente lentas. Se colocó un cristal de permanganato de potasio (KMnO)4) Tomará la mayor parte de la lección disolverse y esparcirse por la base de la taza.
En esta variación de la reacción de la célula de Traub, vemos una burbuja de líquido azul que primero flota y luego se hunde a medida que el agua se difunde en el líquido amarillo circundante, lo que muestra en segundos la difusión de las moléculas de agua. Puede explorar la difusión y la densidad con entre 11 y 14 alumnos mediante esta demostración. También puede utilizar esta demostración con entre 16 y 18 alumnos para desarrollar su comprensión de la química de los metales de transición y perfeccionar su preparación de soluciones estándar.
varios
- 10 centímetros3 A partir de sulfato de cobre (II) 0,4265 M (CuSO4) Solución
- 40cm3 A partir de 0,2808 M de hexacianoferato de potasio (II) (K4Hierro (CN)6) Solución
- Tubo de ebullición o tubo de ensayo grande (20 x 150 mm)
- Abrazadera y soporte, o 250 cm3 matraz de cultivo celular
- Pipeta de gota (ver consejos)
preparar
Las soluciones de sulfato de cobre (II) y hexcianoferato de potasio, cuando se componen como se detalla en la lista del kit, deben dar como resultado que las densidades de las dos soluciones tengan una diferencia de aproximadamente 0,2 %, por lo que es necesario tener cuidado al preparar las soluciones. . El material debe producirse con una precisión de al menos 100 cm.3 Un matraz aforado, que luego se puede utilizar en diversas demostraciones.
Masa récord 100 cm.3 Pesar previamente con cuidado un matraz aforado de 10,65 g de sulfato de cobre (II) pentahidratado (CuSO).40,5 horas2O) Transferirlo al matraz aforado. Añadir 50-75 cm3 de agua desionizada al vaso de precipitados y agite hasta que el sulfato de cobre (II) se disuelva por completo. Luego agregue lentamente agua desionizada al vaso de precipitados hasta la línea, mezcle bien y registre la masa final. Repetir el proceso en otra pieza de 100 cm.3 Un matraz aforado que contiene 11,86 g de hexacianoferato de potasio (II) (K4[Fe(CN)6].3 horas2Ey). Tenga en cuenta que el hexcianoferrato de potasio (II) es de color amarillo y no debe confundirse con el hexcianoferrato de potasio (III) de color naranja.
Fijar el tubo de ebullición y verter 40 cm en él.3 de solución amarilla de hexcianoferato de potasio (II), dejando espacio en la parte superior para el desplazamiento de la pipeta. Vierta unos 10 cm.3 de solución de sulfato de cobre (II) azul en una taza pequeña para evitar contaminar el material con la pipeta.
Salud, seguridad y eliminación
- Use protección para los ojos.
- Evite exponer el hexcianoferrato (II) de potasio a cualquier fuente de calor. Los miembros de CLEAPSS deben consultar HC079.
- El sulfato de cobre (II) es dañino si se ingiere y puede causar daños oculares graves. Evite el contacto con la piel. Los miembros de CLEAPSS deben consultar HC027c.
- Para eliminarlos, filtrar las soluciones precipitadas y diluirlas con abundante agua. Deseche las soluciones diluidas por el desagüe de aguas residuales.
Salud, seguridad y eliminación
- Use protección para los ojos.
- Evite exponer el hexcianoferrato (II) de potasio a cualquier fuente de calor. Los miembros de CLEAPSS deben consultar HC079 (bit.ly/49b46N8).
- El sulfato de cobre (II) es dañino si se ingiere y puede causar daños oculares graves. Evite el contacto con la piel. Los miembros de CLEAPSS deben consultar HC027c (bit.ly/3UKCcDh).
- Para eliminarlos, filtrar las soluciones precipitadas y diluirlas con abundante agua. Deseche las soluciones diluidas por el desagüe de aguas residuales.
En medio de la clase
Llene la pipeta con suficiente solución de sulfato de cobre (II) azul para administrar una gota del tamaño de un guisante (consulte Consejos). Inserte con cuidado el gotero, minimizando la alteración de la solución amarilla, hasta que su punta esté 1-2 cm por encima de la base del tubo. Inyecte la gota y retire la pipeta rápidamente (esto ayuda a iniciar el movimiento ascendente si sus soluciones tienen una densidad muy similar). Se forma una película de color marrón rojizo alrededor de la gota y ésta comenzará a subir. Después de unos instantes en la superficie, la gota cae a la base del tubo, donde durante los siguientes dos minutos se encogerá visiblemente y la película se disolverá.
Este proceso se puede repetir hasta que la densidad de la solución amarilla circundante coincida con la densidad de la solución azul que se está introduciendo.
consejo
- Siempre verifique las densidades de las soluciones de sulfato de cobre y hexacianoferato de potasio después de prepararlas; si la solución de cobre se hunde, la demostración fallará.
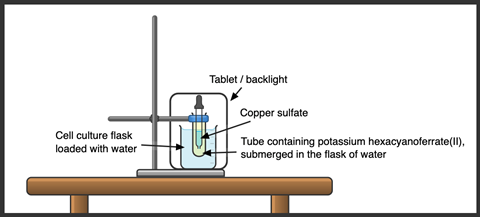
- Para clases más numerosas, utilice un dispositivo visual o una cámara web para que los estudiantes puedan ver los detalles. Enrosque el tubo en un recipiente rectangular lleno de agua para reducir el impacto del agua en el tubo en la lente y mejorar en gran medida la visibilidad de las gotas en la pantalla. 250cm3 Para este propósito es ideal un matraz de cultivo celular con un tubo de ensayo mediano (20 x 150 mm), y puede colocar el dispositivo frente a un fondo blanco o una pantalla para iluminar las soluciones.
- Aunque para esta demostración se puede utilizar una pipeta de tetina normal, una pipeta Pasteur conectada a una jeringa pequeña con un tubo de silicona requiere menos habilidad. Puedes encontrar los consejos en el archivo adjunto. video.
consejo
- Siempre verifique dos veces la solución de sulfato de cobre y hexacianoferrato de potasio después de prepararlos; si la solución de cobre se hunde, la demostración fallará.
- Para clases más numerosas, se necesitará un camarógrafo o una cámara web para ver los detalles. Enrosque el tubo en un recipiente rectangular lleno de agua para reducir el impacto del agua en el tubo en la lente y mejorar en gran medida la visibilidad de las gotas en la pantalla. 250cm3 Para este propósito es ideal un matraz de cultivo celular con un tubo de ensayo mediano (20 x 150 mm), y puede colocar el dispositivo frente a un fondo blanco o una pantalla para iluminar las soluciones.
- Aunque para esta demostración se puede utilizar una pipeta de tetina normal, una pipeta Pasteur conectada a una jeringa pequeña con un tubo de silicona requiere menos habilidad. Puede encontrar los consejos en el vídeo adjunto (rsc.li/3OJxF0c).
Objetivo de enseñanza
Después de agregar sulfato de cobre (II) a una solución de hexacianoferato (II) de potasio, se formará una película sólida coloidal de hexacianoferato de cobre (II) alrededor de la gota. La ecuación balanceada para esta reacción es:
2 Cor2+ (Aq) + Fe(CN)64- (Aq) → Cobre2Hierro (CN)6 (s)
Calcula las densidades de cada uno dividiendo la masa de los líquidos en el vaso por 100. La densidad de la solución azul es aproximadamente 1,062 g cm3.-3 Mientras que la solución amarilla debe estar cerca de 1,065 g/cm-3. Esta pequeña diferencia de densidad hace que la gota azul suba lentamente.
Los estudiantes deben estar familiarizados con el proceso de difusión: el movimiento de moléculas desde áreas de alta concentración a áreas de baja concentración mediante un movimiento aleatorio. Si la membrana separa las moléculas, esto puede impedir que algunas sustancias se propaguen fácilmente. En este caso, el agua se difunde en una solución amarilla de hexcianoferrato(II) de potasio, que, aunque tiene menor concentración de soluto, tiene mayor concentración de agua. Esto puede parecer contradictorio para los estudiantes, así que recuérdeles que está interesado en la concentración de agua en cada solución. Las moléculas de agua son más ligeras que los iones de cobre (II) hexacuatro, por lo que una vez que el agua se esparce, la densidad dentro de la gota aumenta y se hunde. Puedes calcular la concentración de agua en las soluciones para mostrar que la concentración de agua es mayor en la solución azul.
En este ejemplo se disolvieron 6,81 g de sulfato de cobre y 10,34 g de hexacianoferrato (II) de potasio, lo que significa que las concentraciones en el agua son aproximadamente 55,2 mol dM.-3 y 53,4 mol dm-3 En soluciones azules y amarillas respectivamente. Esto explica por qué el agua se difunde fuera de la gota.
Objetivo de enseñanza
Después de agregar sulfato de cobre (II) a una solución de hexacianoferato (II) de potasio, se formará una «película» coloidal sólida de hexacianoferrato de cobre (II) alrededor de la gota. La ecuación balanceada para esta reacción es:
2 Cor2+ (Aq) + Fe(CN)64- (Aq) → Cobre2Hierro (CN)6 (s)
La densidad se puede calcular dividiendo la masa de los líquidos en el vaso por 100. La densidad de la solución azul es 1,062 g cm3.-3 Mientras que la solución amarilla debe estar cerca de 1,065 g/cm-3. Esta pequeña diferencia de densidad hace que la gota azul suba lentamente.
Los estudiantes deben estar familiarizados con el proceso de difusión, el movimiento de moléculas desde áreas de alta a baja concentración mediante un movimiento aleatorio. Si la membrana separa las moléculas, esto puede impedir que algunas sustancias se propaguen fácilmente. En nuestro caso, el agua se difunde en una solución de hexacianoferrato (II) de potasio de color amarillo, que aunque tiene menor concentración de soluto, tiene mayor concentración de agua. Esto puede parecer contradictorio para los estudiantes, así que recuérdeles que está interesado en la concentración de agua en cada solución. Las moléculas de agua son más ligeras que los iones de cobre (II) hexacuatro, por lo que una vez que el agua se esparce, la densidad dentro de la gota aumenta y se hunde.
Puedes calcular la concentración de agua en las soluciones para mostrar que la concentración de agua es mayor en la solución azul. Esto explica por qué el agua se difunde fuera de la gota.

«Alborotador. Amante de la cerveza. Total aficionado al alcohol. Sutilmente encantador adicto a los zombis. Ninja de twitter de toda la vida».





More Stories
Tiziana comparte resultados prometedores del forelumab intranasal en el tratamiento de la esclerosis múltiple
El estudio encontró que los loros prefieren videollamadas en vivo con otros loros a videos pregrabados
Investigadores japoneses están desarrollando materiales sostenibles para pantallas