Crédito: Sjoers Shires
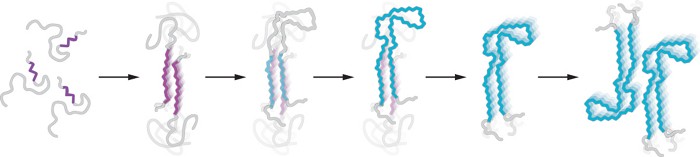
Un diagrama basado en varias estructuras observadas por los investigadores muestra cómo creen que los monómeros tau (izquierda) se ensamblan en una hebra intermedia común (segunda desde la izquierda), que luego puede estabilizarse en formas más estables (derecha).
Las enfermedades neurodegenerativas como la enfermedad de Alzheimer, la demencia frontotemporal y la encefalopatía crónica tienen síntomas diferentes, pero comparten una característica: la presencia de hebras de proteína tau mal plegadas en el cerebro de los pacientes. En un nuevo estudio, los científicos del Laboratorio de Biología Molecular del Consejo de Investigación Médica informan detalles sin precedentes sobre cómo los amiloides tau se agregan y se estabilizan (naturaleza2023, DOI: 10.1038/s41586-023-06788-s).
Si bien muchas enfermedades se caracterizan por agregados de tau, en los últimos años los investigadores han encontrado diferencias estructurales sutiles entre las hebras asociadas con esas enfermedades. Incluso vincularon las diferencias en la morfología con la velocidad de progresión de la enfermedad (Ciencia ficción. a través de. Medicina. 2022, identificación digital: 10.1126/scitranslmed.abg0253). Los investigadores no están seguros de cómo surgen las diversas conformaciones de los filamentos ni de cómo se forman los filamentos tau.
En el nuevo estudio, la estudiante de posgrado Sophia Löfstam y sus colegas de los grupos de investigación de Sjors Scheres y Michel Goedert investigaron cómo parte de la proteína tau se ensambla en dos tipos de fibras.
Comenzaron utilizando espectroscopia de resonancia magnética nuclear para comprender la estructura flexible del monómero. Si bien la mayor parte de la proteína se mueve como espagueti cocido, dice Shires, algunas áreas están en buena forma; Su rigidez favorece la formación de hilos.
Luego, los investigadores examinaron la agregación a lo largo del tiempo. usaron Protocolo para la formación de filamentos. Durante el cual tau se auto-sembra en un buffer simple. Un tampón que contiene cloruro de magnesio puede producir filamentos similares a los que se encuentran en el cerebro de las personas con la enfermedad de Alzheimer. Si el tampón contuviera cloruro de sodio, los filamentos se parecerían a los que se encuentran en el cerebro de personas con encefalopatía crónica. Utilizando microscopía electrónica criogénica, pudieron identificar docenas de estructuras de filamentos diferentes a medida que avanzaba cada reacción.
Las estructuras mostraron algo inesperado: los primeros filamentos parecieron formarse en ambas vías. Esta cohesión luego explotó en una cacofonía de hilos de diferentes formas antes de que ambas reacciones finalmente se establecieran en sus propios hilos finales.
«Históricamente, se ha propuesto que las fibrillas de amiloide son agregados relativamente estables que no cambian con el tiempo», dice en un correo electrónico el biólogo estructural Lukas Joakimiak del Centro Médico Southwestern de la Universidad de Texas, que no participó en el estudio. La presencia de los intermediarios fue inesperada, y los fugaces hilos comunes lo fueron aún más, aunque «su presencia explica gran parte de la bioquímica que se ha informado anteriormente», dice Shires.
Para explicar cómo pueden surgir diferentes formas de filamentos a partir del mismo punto de partida, los investigadores proponen una competencia entre formas de amiloide cinéticamente accesibles y termodinámicamente estables. Puede ser más fácil para la proteína acceder al primer intermedio desde el estado de solución monomérica, pero es más probable que otras conformaciones se estabilicen una vez que la proteína está en la cadena. La conformación más estable a largo plazo depende del entorno químico inicial.
Byron Caughey, experto en priones de los Institutos Nacionales de Salud, califica el estudio como «un avance técnico sorprendente que realmente nos ayuda a pensar en cómo comienzan las taopatías…». La pregunta más importante que esto plantea, dice, es si los filamentos intermedios de tau pueden ser atacados en el cerebro de los pacientes, o si hace tiempo que desaparecieron con el inicio de la enfermedad.
La reacción de formación de fibrillas es mucho más sencilla que la de las neuronas. La sección corta de tau comprende sólo alrededor de una cuarta parte de la proteína de longitud completa, y el sistema excluye las modificaciones covalentes y las parejas de unión no covalentes que se sabe que son importantes en el ensamblaje de tau. Debido a que cada mediador tiene una vida corta, será difícil determinar si realmente surgen en el cerebro durante las enfermedades neurodegenerativas. Sin embargo, el conocimiento de estas estructuras podría resultar útil a la hora de diseñar moléculas cuyo objetivo sea «apuntar a las semillas de agregación, justo al comienzo del proceso de siembra», afirma Helio Albuquerque, investigador postdoctoral de la Universidad de Aveiro, que no participó en el proyecto. . Estudiar por correo electrónico.
Noticias de química e ingeniería.
ISSN 0009-2347
Copyright © 2023 Sociedad Química Estadounidense

«Alborotador. Amante de la cerveza. Total aficionado al alcohol. Sutilmente encantador adicto a los zombis. Ninja de twitter de toda la vida».






More Stories
Los científicos revelan qué es lo que realmente los hace brillar
Huellas de dinosaurios en China apuntan a aves rapaces gigantes que desafían las representaciones del Parque Jurásico
Recuperación científica en el telescopio espacial Hubble después de un problema de rotación